【醫(yī)學(xué)新視點(diǎn)】胃旁路手術(shù)改善胰島素抵抗的機(jī)制探討
在肥胖和代謝綜合征的治療中,代謝手術(shù)目前被認(rèn)為是最有效和可持續(xù)的治療方法,眾多研究都已證明代謝手術(shù)可以改善2型糖尿病的病情和其帶來(lái)的各種并發(fā)癥,并且這種改善是單獨(dú)作用的,并非是因?yàn)榘殡S著體重減輕而帶來(lái)的作用。那為何代謝手術(shù)能為病患帶來(lái)如此顯著的療效呢?要知道,對(duì)于代謝手術(shù)的作用機(jī)制研究一直是熱點(diǎn),今天,一帆老師就為大家?guī)?lái)一篇“探討胃旁路手術(shù)后的代謝變化以及可能的作用機(jī)制”的文獻(xiàn)報(bào)道。
這項(xiàng)研究來(lái)自于伊利諾伊州芝加哥大學(xué)外科系和三峽大學(xué)附屬宜昌市中心人民醫(yī)院外科,是一項(xiàng)中外合作的動(dòng)物研究。該研究圍繞慢性低度炎癥展開(kāi),因?yàn)槁缘投妊装Y被認(rèn)為在胰島素抵抗的發(fā)生中起到重要的作用。而肥胖癥患者巨噬細(xì)胞活化是胰島素抵抗的常見(jiàn)致病機(jī)制,在這些患者體內(nèi),巨噬細(xì)胞從M2樣活化狀態(tài)轉(zhuǎn)變?yōu)榻?jīng)典的M1樣活化狀態(tài),而T細(xì)胞亞群如CD4、CD8和調(diào)節(jié)性T細(xì)胞(CD4/FoxP3)作為促進(jìn)和調(diào)節(jié)炎癥反應(yīng)的媒介出現(xiàn)。這些炎癥反應(yīng)導(dǎo)致Jun NH2末端激酶(JNK)/激活蛋白1(AP-1)信號(hào)通路的激活,從而觸發(fā)促炎細(xì)胞因子的轉(zhuǎn)錄,以及胰島素受體底物蛋白中絲氨酸的磷酸化。胃旁路手術(shù)后,病人的炎癥生物標(biāo)志物被觀察到發(fā)生了一系列的變化,甚至手術(shù)1-2年后,仍能看到炎癥標(biāo)志物的改善。
為了探討胃旁路手術(shù)對(duì)慢性炎癥的調(diào)節(jié)與肥胖、胰島素抵抗的改善是否相關(guān),研究人員在小鼠身上進(jìn)行了實(shí)驗(yàn)。研究結(jié)果發(fā)現(xiàn),接受胃旁路手術(shù)的小鼠表現(xiàn)出攝食量下降,持續(xù)的體重減輕和脂肪減少(圖1)。
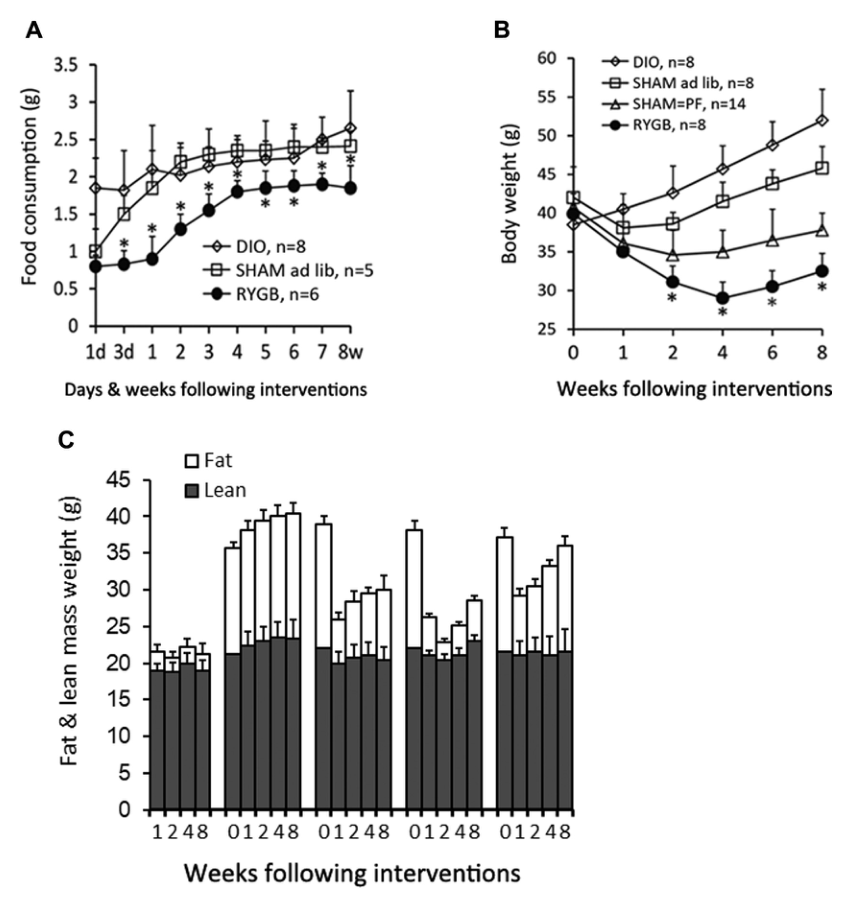
圖1 胃旁路手術(shù)后 A:攝食量 B:體重 C:脂肪和瘦肉含量
空白組肥胖小鼠體內(nèi)胰島素水平顯著高于瘦小鼠,胃旁路術(shù)后小鼠血漿胰島素水平顯著下降,糖耐量持續(xù)改善,血瘦素、脂聯(lián)素水平顯著升高(圖2)。


圖2 糖耐量、血瘦素、脂聯(lián)素在術(shù)后的改變
觀察到術(shù)后小鼠的肝臟、附睪水和肌肉組織中組織特異性的NF-κB激活。JNK和c-Jun在肥胖小鼠肝臟和白色脂肪組織中的磷酸化增強(qiáng),但在肌肉中沒(méi)有。胃旁路術(shù)和假手術(shù)組均抑制C-Jun氨基末端激酶JNK和c-Jun的磷酸化(圖3)。
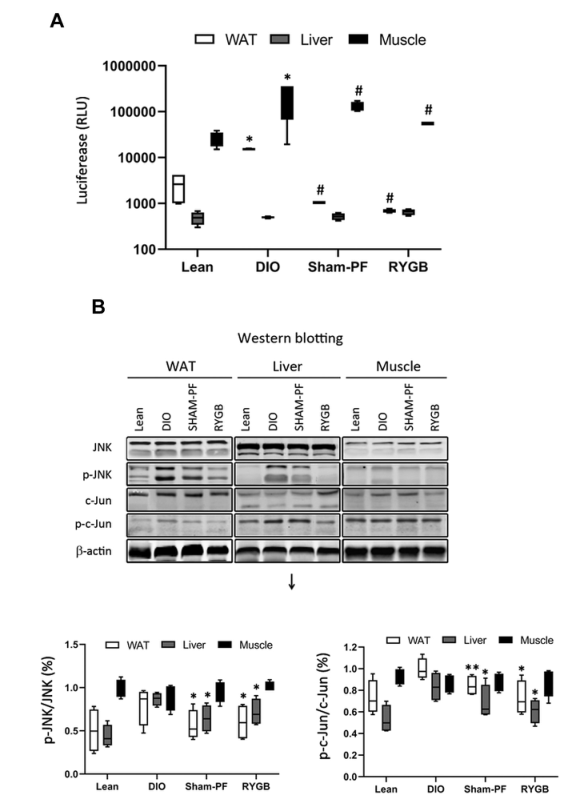
圖3 NF-kB活性變化和JNK和c-Jun磷酸化
胃旁路術(shù)抑制肝臟和脂肪組織中單核細(xì)胞趨化蛋白-1(MCP-1)和白細(xì)胞介素-6(IL-6)的產(chǎn)生(圖4)。

圖4 MCP-1和IL-6信使RNA(MRNAs)變化
胃旁路術(shù)顯著抑制肝臟和白色脂肪組織中的巨噬細(xì)胞M1樣亞群和維持M2樣亞群。而且,研究人員發(fā)現(xiàn),肥胖小鼠體內(nèi)原本會(huì)發(fā)生M1增加、M2減少(圖5)。
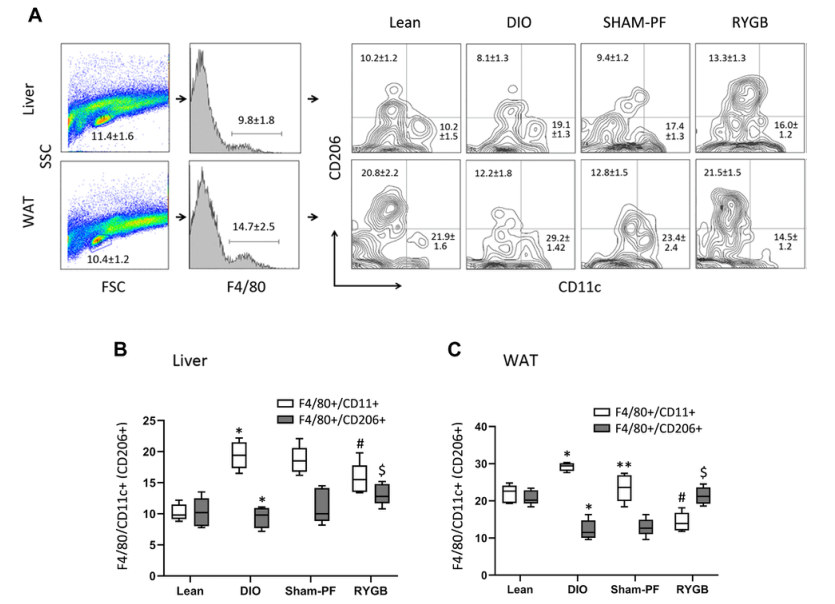
圖5 流式細(xì)胞儀分析巨噬細(xì)胞亞群
胃旁路術(shù)還對(duì)肝臟和白色脂肪組織特異性T細(xì)胞亞群產(chǎn)生了影響,術(shù)后1wk時(shí),肥胖小鼠肝臟和白色脂肪組織的CD4+(CD3 /CD8-)和CD8+( CD3 /CD4-)T細(xì)胞顯著增加(圖6)。
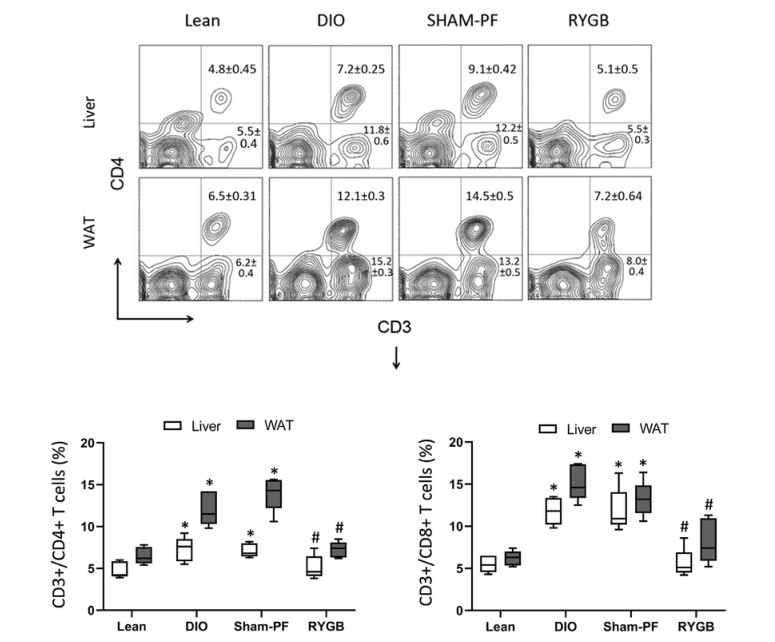
圖6 流式細(xì)胞儀分析T細(xì)胞亞群
經(jīng)過(guò)一系列數(shù)據(jù)分析后,研究人員認(rèn)為,NF-κB具有激活巨噬細(xì)胞釋放炎癥因子的作用,引發(fā)炎癥反應(yīng),而在肥胖小鼠體內(nèi)發(fā)現(xiàn)高活性的NF-κB。胃旁路術(shù)可以顯著抑制白色脂肪組織和肌肉中的NF-κB活性,但是在肝臟中,無(wú)論是胃旁路術(shù)還是假手術(shù)都對(duì)NF-κB的活性沒(méi)有影響,這一點(diǎn)很有趣,說(shuō)明肝臟中另有其他通路來(lái)激活NF-κB。
JNK是絲裂原活化蛋白激酶的成員。野生型JNK在肝臟中的表達(dá)增加降低了胰島素敏感性,而抑制JNK通路導(dǎo)致胰島素抵抗的改善。JNK信號(hào)通路的一個(gè)主要靶點(diǎn)是激活由c-jun磷酸化介導(dǎo)的AP-1轉(zhuǎn)錄因子。與高脂飲食相關(guān)的肝臟胰島素抵抗是通過(guò)激活肝臟JNK/AP-1信號(hào)通路來(lái)介導(dǎo)的,而不是通過(guò)激活核因子-kB來(lái)介導(dǎo)肝纖維化和非酒精性脂肪性肝炎。胃旁路術(shù)導(dǎo)致肝臟JNK的磷酸化抑制,這可能有助于改善血糖控制。肥胖與白色脂肪組織中巨噬細(xì)胞尤其是M1巨噬細(xì)胞的滲透增加有關(guān)。
這種滲透的增加導(dǎo)致促炎基因的高表達(dá),如腫瘤壞死因子(TNF)-a,誘導(dǎo)型一氧化氮合酶和IL-6,所有這些都促使發(fā)生胰島素抵抗。胃旁路術(shù)導(dǎo)致MCP-1的減少,MCP-1在巨噬細(xì)胞募集到脂肪組織中起著至關(guān)重要的作用。手術(shù)還抑制了肝和白色脂肪組織中與M2樣群增加相關(guān)的M1樣分化(F4/80 +/CD11c+)。這些發(fā)現(xiàn)與之前在人類身上觀察到的結(jié)果一致,表明手術(shù)能使人白色脂肪組織和血漿中促炎標(biāo)記物的表達(dá)減少。
高脂喂養(yǎng)會(huì)導(dǎo)致肝臟和白色脂肪組織中CD4+和CD8+T細(xì)胞的增加,這與巨噬細(xì)胞激活和局部炎癥反應(yīng)的持續(xù)存在以及胰島素抵抗的發(fā)展有關(guān)。手術(shù)能抑制CD4+和CD8+細(xì)胞的滲透,并促進(jìn)肝臟和白色脂肪組織中的Treg細(xì)胞。這些影響在節(jié)食減肥中是觀察不到的。瘦素和脂聯(lián)素是真正的脂肪因子,僅由脂肪細(xì)胞產(chǎn)生,分別介導(dǎo)炎癥和抗炎反應(yīng)。試驗(yàn)中觀察到血漿瘦素持續(xù)下降和血漿脂聯(lián)素升高,有助于調(diào)節(jié)細(xì)胞免疫反應(yīng)。
總之,該研究發(fā)現(xiàn)胃旁路手術(shù)可以改善肥胖和胰島素抵抗,而這與調(diào)節(jié)肝臟和白色脂肪組織的早期炎癥反應(yīng)有關(guān)。
代謝手術(shù)作為治療肥胖和糖尿病的最佳方法,其療效在臨床中反復(fù)得到驗(yàn)證,不過(guò),凡是手術(shù)必然會(huì)帶來(lái)風(fēng)險(xiǎn),況且傳統(tǒng)的代謝手術(shù)均為不可逆操作,對(duì)胃腸結(jié)構(gòu)進(jìn)行重排,而正是因此,此類手術(shù)在國(guó)內(nèi)應(yīng)用尚少,接受度也不高,能開(kāi)展的醫(yī)院也較有限。對(duì)此,有創(chuàng)新醫(yī)療器械廠家借由代謝手術(shù)的原理,研發(fā)出了近乎無(wú)創(chuàng)的胃鏡下介入器械:胃轉(zhuǎn)流支架系統(tǒng)。(圖7)

圖7: “糖吉醫(yī)療”胃轉(zhuǎn)流支架系統(tǒng)及其原理示意(右)
胃轉(zhuǎn)流手術(shù)是通過(guò)外科手術(shù)方式,將患者的胃分成上下兩部分,用于容納食物的只有原來(lái)胃部的1/6-1/10,然后在小胃的切口處開(kāi)一條“岔路”,接上截取的一段小腸,重新排列小腸的位置,改變食物經(jīng)過(guò)消化道的途徑,減緩胃排空速度,縮短小腸,降低吸收,從而達(dá)到減肥的目的。而胃轉(zhuǎn)流支架則是借鑒了胃轉(zhuǎn)流手術(shù)的原理,以微創(chuàng)介入的方式,通過(guò)胃鏡在十二指腸及空腸上段置入一個(gè)套管隔離食糜,置入后,來(lái)自胃內(nèi)的食糜由套管腔內(nèi)通過(guò),膽汁及胰液等隔離在套管外,使得膽汁胰液和食物“分流”于遠(yuǎn)端匯合,同樣減少了對(duì)食物的消化吸收。
簡(jiǎn)而言之,它能起到與胃轉(zhuǎn)流術(shù)一樣的效果,但卻不需要腹腔鏡手術(shù),只需要在無(wú)痛胃鏡下即可放置和回收,相比于傳統(tǒng)減重外科代謝手術(shù)更微創(chuàng)、更安全、不損傷人體結(jié)構(gòu),是一項(xiàng)非常有前景的新技術(shù)。并且,由于其起效原理與胃旁路轉(zhuǎn)流外科手術(shù)類似,其對(duì)人體代謝和免疫的影響及改善應(yīng)該也是類似的,一帆老師認(rèn)為,同類型的基礎(chǔ)科學(xué)研究也很有必要開(kāi)展,期待未來(lái)我們能看到更多關(guān)于這類新技術(shù)、新療法的科學(xué)研究或報(bào)道,屆時(shí)一帆老師將會(huì)繼續(xù)從醫(yī)學(xué)角度為大家進(jìn)行詳細(xì)解讀。
參考文獻(xiàn):
[1]Xu R, Zhu C, Li Y, Andrade M, Yin DP. Gastric Bypass Regulates Early Inflammatory Responses in High-Fat Diet-Induced Obese Mice. J Surg Res. 2022;273:161-171. doi:10.1016/j.jss.2021.12.027
一帆老師:
浙江大學(xué)臨床醫(yī)學(xué)碩士,醫(yī)學(xué)博士在讀
內(nèi)科主治醫(yī)師
醫(yī)學(xué)院校教師
主要從事臨床醫(yī)學(xué)專業(yè)理論和臨床技能操作課程教學(xué)與科研工作。教學(xué)工作獲浙江省政府教學(xué)成果獎(jiǎng)。臨床工作主要研究糖尿病、肥胖 、代謝綜合征相關(guān)領(lǐng)域。



