【醫學新視點】談十二指腸空腸套管的作用機制——腸道微生態
引言:
腸道菌群是目前臨床研究的熱點領域,多項研究一致表明,腸道微生物群是2型糖尿病(T2DM)病理生理學中一個新的、潛在的驅動因素,與肥胖癥、低度炎癥、胰島素抵抗和T2DM等代謝性疾病之間相互影響,甚至在其中可能扮演著關鍵樞紐的角色。
與瘦人相比,肥胖者腸道中的厚壁菌門/擬桿菌門比值增大,細菌多樣性減少,而在胃旁路術(Roux-en-Y gastric bypass,RYGB)后,這種趨勢發生了逆轉,術后可檢測到厚壁菌門比例減小,擬桿菌門比例增大。有研究表明擬桿菌比例增多可以引起更多的葡萄糖依賴性促胰島素分泌多肽(GIP)和胰高血糖素樣肽-l(GLP-1)釋放,從而改善血糖。十二指腸空腸套管(DJBS)術與RYGB原理類似,所以推測DJBS術也有類似效果。
正文:
腸道菌群為定植在人體腸道內的微生物,由超過3500種細菌組成,細菌重量約為1.5kg,主要來自于9個菌門,其中厚壁菌門(firmicutes)、擬桿菌(bacteroidetes)占總數80%~90%。腸道菌群從人體出生時便開始形成,并與之長期協同進化,影響人體的營養、能量代謝和免疫——參與營養物質代謝等。其在調節人體正常生理代謝方面具有不可替代的作用,一旦腸道菌群失衡會引發機體代謝、免疫功能紊亂[1]。
近年來,代謝性疾病的發生發展與腸道菌群失衡的關聯,已成為重要的研究靶點,研究者們已提出多種機制解釋腸道菌群的變化與肥胖癥及其他各種代謝性疾病的聯系。既往的研究表明,腸道菌群參與了宿主的膽汁酸、膽固醇代謝,激素代謝和脂代謝等,并為機體代謝通量提供各種酶。其中擬桿菌具有碳水化合物發酵、參與多糖代謝、膽汁酸和類固醇代謝的功能;厚壁菌的主要代謝產物丁酸提高了宿主從飲食中吸收能量的能力,從而與肥胖的發生相關;變形菌是正常腸道中含量最少的菌類,其與感染性和非感染性炎癥性腸道病的發生相關[6]。Turnbaugh等[2]證明,在相同飲食的情況下,無菌瘦小鼠移植肥胖小鼠的腸道菌后,厚壁菌門/擬桿菌門比例增高,脂肪積累增多,瘦小鼠變胖;Backhed F等[3]認為腸道菌群能夠抑制肝臟、肌肉細胞中的腺苷酸激酶,減少脂肪酸氧化,而脂肪酸氧化可以促進細胞能量代謝、減少糖原生成、增加胰島素敏感性;Li F等[4]發現腸道菌群可經初級膽汁酸配體法尼基衍生物受體(farnesoid x receptor,FXR)和G蛋白耦聯膽汁酸受體5(Takeda G protein coupled receptor 5, TGR5)通路影響膽汁酸循環,改變脂肪代謝、抑制肥胖發展。FXR是肝臟脂肪合成、低密度脂蛋白運輸、甘油三酯轉化等脂肪代謝活動的關鍵,TGR5則可促進GLP-1表達增加,并減低甘油三酯水平。此外,高脂飲食引發腸道菌群結構變化,某些腸道格蘭陰性細菌釋放的脂多糖(LPS),會引起炎癥反應,誘發“代謝性內毒素血癥”,介導慢性低度炎癥、肥胖癥及胰島素抵抗等病變的產生 (圖1) [5]。
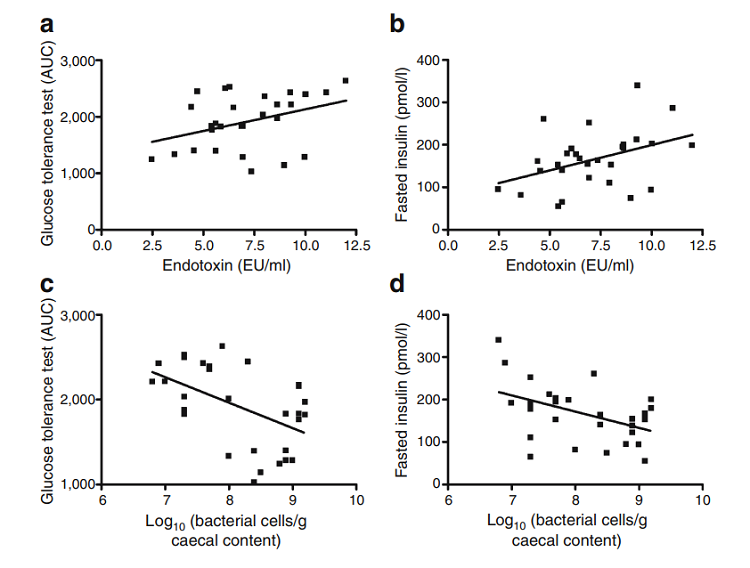
圖1 內毒素含量與葡萄糖耐量、空腹胰島素含量呈正相關(ab);雙歧桿菌屬含量與葡萄糖耐量、空腹胰島素含量呈負相關(cd)
郎敏等[7]研究發現,在接受RYGB治療手術后,厚壁菌門和擬桿菌門的比例發生變化,擬桿菌門比例增加,厚壁菌門比例減少,同時變形菌比例減少(表1);Palleja等則發現術后3個月腸道內多種細菌濃度產生明顯變化,包括大腸桿菌、肺炎克雷伯菌、阿克曼氏菌及普拉氏梭桿菌等,除普拉氏梭桿菌外其他細菌濃度均明顯升高,且手術對腸道菌群的影響可維持至術后1年甚至更久;在其他大量代謝性手術的研究中,RYGB術后患者體重及糖脂代謝均有明顯改善,且效果穩定,這提示腸道菌群種屬、數量的變化是RYGB術有效降低體質量、改善糖脂代謝的可能機制[8,9]。
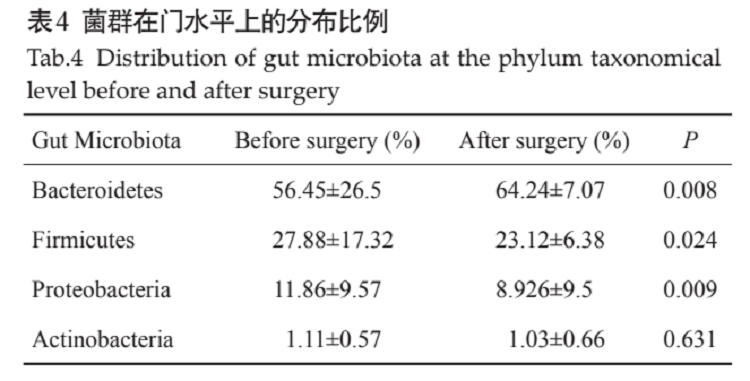
表1 手術前后菌群變化的差異性顯著性檢驗
上述研究結果提示,RYGB術后腸道菌群豐度和構成的恢復可能是減重的機制之一,DJBS術作為一種借鑒了RYGB手術原理的微創內鏡下介入術式,很多療效機制可能與RYGB相同或類似。關于DJBS對腸道菌群的影響,奧地利格拉茨醫科大學的Tripolt NJ等[10]已經啟動了相關研究,這項前瞻性研究招募了接受DJBS置入的糖尿病患者,打算對其進行β細胞功能和胰島素敏感性評估以及混合膳食耐受性測試,并從患者糞便中通過基因測序評估腸道菌群結構,并作長期隨訪觀察;目前,該研究仍在繼續,相關數據還未對外公布,筆者也將持續關注,繼續分享。
據悉,國內已有科研型企業自主研究出了 DJBS 的內鏡下置入器械——胃轉流支架系統,且已開啟面向肥胖癥、2型糖尿病、非酒精性脂肪性肝病等代謝性疾病的臨床試驗。該技術在原有的DJBS器械基礎上做了大量的重新開發和臨床研究,提高了器械操作的安全性和可靠性;目前該項新技術國內尚無同類產品上市,若能在競爭格局尚未形成之前就能將產品推出,有望為眾多因懼怕外科手術永久性傷害,或因指征未達到要求而無法通過手術治療的代謝性疾病患者帶來了新的治療選擇。
至此,關于DJBS的作用機制分析綜述告一段落,本系列綜述主要闡述置入DJBS后對患者的影響機制,其中涉及腸促胰島素效應、膽汁酸、胃排空延遲、炎癥反應以及腸道微生物等,通過對臨床試驗數據的分享,以期為國內外研究學者進一步運用提供參考。以此為基礎,筆者也將繼續關注該類研究的進展情況,希望看到更多前瞻性研究能夠更好地驗證這類結論。
參考文獻:
[1]馬漠,劉煜.腸道菌群與肥胖癥的關系及其在肥胖癥治療中的應用[J].中華糖尿病雜志,2017,9(11):726-728.DOI:10.3760/cma.j.issn.1674-5809.2017.11.013.
[2]Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature. 2006;444(7122):1027-1031. DOI:10.1038/nature05414
[3]Backhed F,Manchester JK,Semenkovieh CF,et al.Mechanisms underlying the resistance to diet-induced obesity in germ-free mice[J].Proc Natl Acad Sci USA,2007,104(3):979-984.DOI:10.1073/pnas.0605374104.[4]Li F,Jiang C,Krausz KW,et al.Microbiome remodeling leads to inhibition of intestinal farnesoid X receptor signaling and decreased obesity[J].Nat Commun,2013,4:2384.DOI:10.1038/ncomms3384.
[5] Cani PD,Neyfinck AM,Fava F,et al.Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia[J].Diabetologia,2007,50(11):2374-2383.DOI:10.1007/s00125-007-079l-0.[6] Graessler J, Qin Y, Zhong H, et al. Metagenomic sequencing of the human gut microbiome before and after bariatric surgery in obese patients with type 2 diabetes: correlation with inflammatory and metabolic parameters [J]. Pharmacogenomics J, 2013, 13(6) :514-522. DOI: 10.1038/tpj.2012.43.
[7]郎敏, 鄭克鴻, 曾松華, 等. 肥胖2型糖尿病患者胃旁路術后腸道菌群的變化[J].南方醫科大學學報,2017,37(10) :1337-1344. DOI: 10.3969/j.issn.1673-4254.2017.10.09.
[8]Li JV, Ashrafian H, Bueter M, et al.Metabolic surgery profoundly influences gut microbial-host metabolic cross-talk[J].Gut,2011,60(9):1214-1223.DOI:10.1136/ gut.2010.234708.
[9] Liou AP, Paziuk M, Luevano JM Jr, et al.Conserved shifts in the gut microbiota due to gastric bypass reduce host weight and adiposity[J]. Sci Transl Med, 2013,5(178):178ra41. DOI:10.1126/scitranslmed.3005687.
[10]Tripolt NJ, Aberer F, Url J, et al. Impact of Duodeno-Jejunal Bypass Liner (EndoBarrierTM) Implantation on Insulin Sensitivity in Patients with Type 2 Diabetes Mellitus (T2DM): A Study Protocol for a Pilot Trial. Diabetes Ther. 2019;10(1):299-309. doi:10.1007/s13300-018-0540-z



